A kémia csodálatos világa olyan, mint egy izgalmas felfedezőút, ahol minden lépés új csodákat tár elénk. Ebben a cikkben elmerülünk a vegyületmolekulák rejtélyes birodalmában, és felfedezzük, milyen apró építőkövekből állnak össze ezek a lenyűgöző struktúrák. Készülj fel egy inspiráló utazásra, ahol a mikroszkopikus részecskék tánca egy egész univerzumot tár fel előttünk!
A vegyületmolekulák titokzatos világa
Képzeld el, hogy egy hatalmas, vibráló városba érkezel, ahol minden egyes épület, utca és tér egy-egy molekulát jelképez. Ez a város a vegyületmolekulák birodalma, ahol az élet és az anyag legapróbb építőkövei találkoznak és alkotnak csodálatos struktúrákat. De vajon miből épülnek fel ezek a lenyűgöző „épületek”?
A vegyületmolekulák olyan kémiai részecskék együttese, amelyek különböző atomokból vagy atomcsoportokból állnak össze. Ezek a részecskék kémiai kötésekkel kapcsolódnak egymáshoz, létrehozva a molekulákat, amelyek aztán az anyag tulajdonságait meghatározzák. De nézzük meg közelebbről, milyen izgalmas építőelemekből állnak ezek a molekulák!
Atomok: A molekulák alapkövei
Az atomok a vegyületmolekulák legfontosabb és legalapvetőbb építőkövei. Ezek a parányi részecskék olyan kicsik, hogy szabad szemmel láthatatlanok, mégis hatalmas erőt és potenciált rejtenek magukban. Minden atom egy-egy egyedi „személyiséggel” rendelkezik, ami meghatározza, hogyan viselkedik és kapcsolódik más atomokhoz.
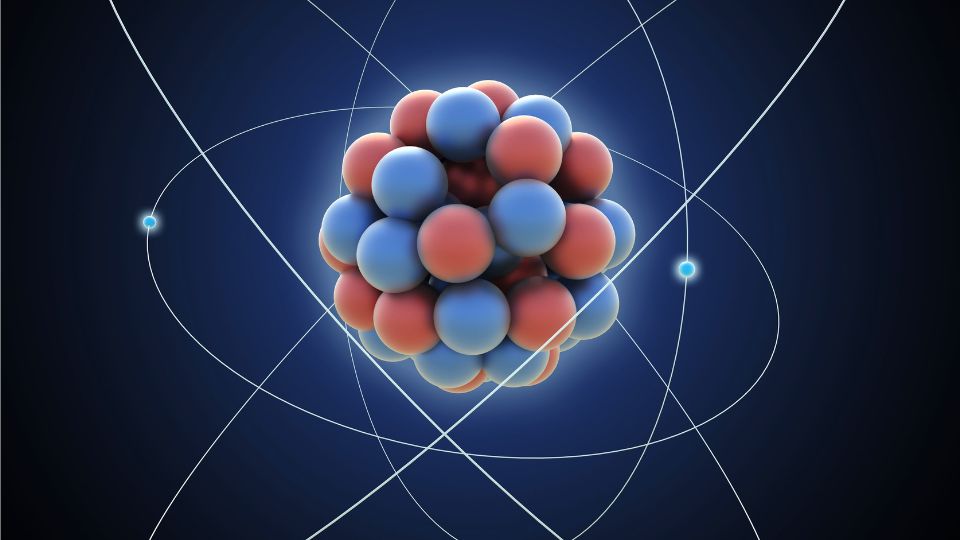
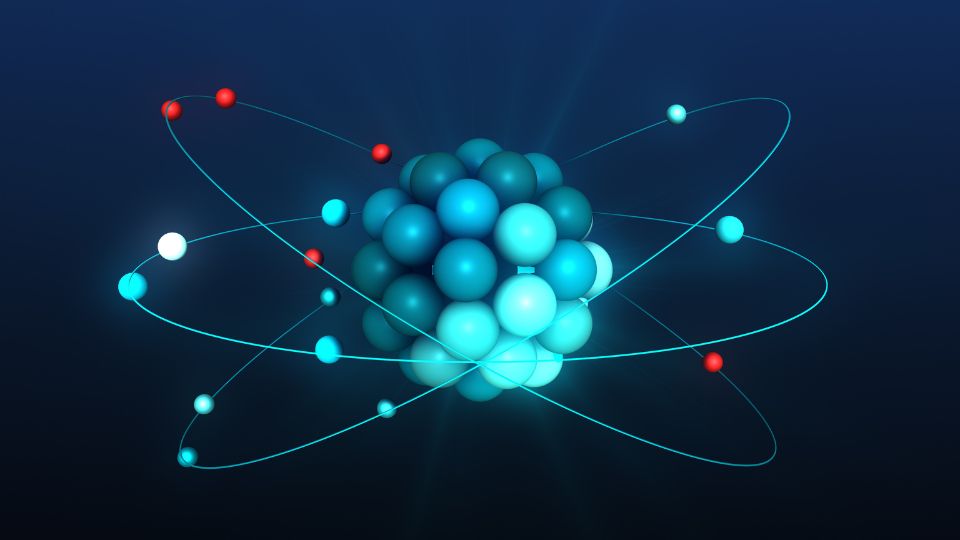
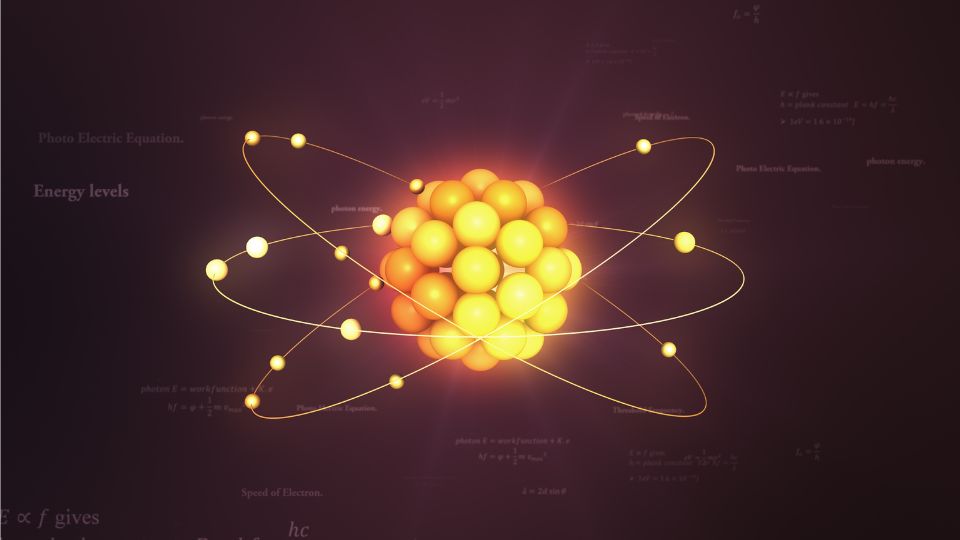
Az atomok szerkezete
Az atomok szerkezete olyan, mint egy miniatűr naprendszer:
- Atommag: Ez a központi „nap”, ami protonokból és neutronokból áll. A protonok pozitív töltésűek, míg a neutronok semlegesek.
- Elektronburok: Az atommag körül keringő elektronok alkotják ezt a réteget. Az elektronok negatív töltésűek és különböző energiaszinteken helyezkednek el.
- Elektronhéjak: Az elektronok koncentrikus héjakban mozognak az atommag körül. Minden héj meghatározott számú elektront tartalmazhat.
Az atomok közötti kölcsönhatások és kötések határozzák meg, hogyan épülnek fel a vegyületmolekulák. Az elektronok elrendeződése és az atomok közötti vonzás és taszítás játssza a főszerepet ebben a lenyűgöző táncban.
Ionok: A töltött táncosok
Az ionok olyan atomok vagy atomcsoportok, amelyek elektromos töltéssel rendelkeznek. Ezek a „töltött táncosok” fontos szerepet játszanak számos vegyületmolekula felépítésében. Az ionok két fő típusát különböztetjük meg:
- Kationok: Pozitív töltésű ionok, amelyek elektronokat vesztettek.
- Anionok: Negatív töltésű ionok, amelyek extra elektronokat nyertek.
Az ionok közötti vonzás és taszítás hozza létre az ionos kötéseket, amelyek számos vegyület, például a konyhasó (NaCl) alapját képezik. Az ionos vegyületek gyakran kristályos szerkezetűek és magas olvadásponttal rendelkeznek.
| Ion típusa | Töltés | Példa |
|---|---|---|
| Kation | Pozitív | Na+ (nátrium-ion) |
| Anion | Negatív | Cl- (klorid-ion) |
Kovalens kötések: Az atomok ölelése
A kovalens kötések olyan erős kapcsolatok, amelyek során az atomok közösen használnak elektronokat. Ez olyan, mintha az atomok szorosan átölelnék egymást, megosztva legértékesebb „kincseiket” – az elektronjaikat. A kovalens kötések különböző típusai léteznek:
- Egyszeres kötés: Két atom egy elektronpárt oszt meg egymással.
- Kettős kötés: Két atom két elektronpárt oszt meg.
- Hármas kötés: Két atom három elektronpárt oszt meg.
A kovalens kötések rendkívül fontosak az élet szempontjából. Például a vízmolekulákban (H2O) a hidrogén- és oxigénatomok kovalens kötésekkel kapcsolódnak össze, létrehozva azt az anyagot, ami nélkül az élet elképzelhetetlen lenne a Földön.
Molekulapályák: Az elektronok táncterme
A molekulapályák olyan területek a molekulán belül, ahol az elektronok a legnagyobb valószínűséggel tartózkodnak. Ezek a „táncteremek” határozzák meg a molekula alakját és tulajdonságait. A molekulapályák elmélete segít megérteni, hogyan oszlanak meg az elektronok a molekulán belül, és hogyan befolyásolják a vegyület viselkedését.
Molekulapályák típusai
- Kötő molekulapályák: Ezek erősítik az atomok közötti kötéseket.
- Lazító molekulapályák: Gyengítik az atomok közötti kötéseket.
- Nemkötő molekulapályák: Nem járulnak hozzá közvetlenül a kötésekhez.
A molekulapályák megértése kulcsfontosságú a kémiai reakciók és a molekulák viselkedésének előrejelzéséhez.
Funkciós csoportok: A molekulák egyedi jellemzői
A funkciós csoportok olyan atomok vagy atomcsoportok, amelyek meghatározzák egy molekula kémiai tulajdonságait és reaktivitását. Ezek olyan, mint a molekulák „személyiségjegyei”, amelyek befolyásolják, hogyan viselkednek és reagálnak más anyagokkal.
Néhány fontos funkciós csoport:
- Hidroxilcsoport (-OH): Alkoholokban található.
- Karboxilcsoport (-COOH): Szerves savakban jellemző.
- Aminocsoport (-NH2): Aminosavakban és más szerves vegyületekben fordul elő.
- Aldehidcsoport (-CHO): Aldehidekben található.
A funkciós csoportok ismerete segít előre jelezni egy vegyület tulajdonságait és reakcióit.
Intermolekuláris erők: A molekulák közötti vonzalom
Az intermolekuláris erők olyan gyenge kölcsönhatások, amelyek a molekulák között lépnek fel. Bár gyengébbek, mint a kovalens vagy ionos kötések, mégis rendkívül fontosak a vegyületek fizikai tulajdonságainak meghatározásában.
Főbb típusai:
- Van der Waals-erők: Gyenge vonzóerők minden molekula között.
- Dipólus-dipólus kölcsönhatások: Poláris molekulák között lépnek fel.
- Hidrogénkötés: Erős intermolekuláris erő, amely hidrogénatomot tartalmazó poláris molekulák között alakul ki.
Az intermolekuláris erők befolyásolják például egy anyag olvadás- és forráspontját, valamint oldhatóságát.
Komplex vegyületek: A molekulák szupersztárjai
A komplex vegyületek olyan különleges molekulák, amelyekben egy központi fémion körül ligandumok (más molekulák vagy ionok) helyezkednek el. Ezek a „szupersztár” molekulák gyakran lenyűgöző színekkel és egyedi tulajdonságokkal rendelkeznek.
A komplex vegyületek fontos szerepet játszanak:
- Biológiai folyamatokban (pl. hemoglobin)
- Ipari katalizátorokban
- Színes festékekben és pigmentekben
| Komplex vegyület | Központi fémion | Ligandumok | Szín |
|---|---|---|---|
| Hemoglobin | Fe2+ | Porfirin gyűrű | Vörös |
| Klorofill | Mg2+ | Porfirin származék | Zöld |
A kvantummechanika varázslatos világa
A kvantummechanika egy olyan lenyűgöző terület, amely segít megérteni az atomok és molekulák viselkedését a legapróbb szinten. Ez a elmélet olyan jelenségeket magyaráz meg, amelyek klasszikus fizikával nem érthetők:
- Hullám-részecske kettősség: Az elektronok egyszerre viselkedhetnek hullámként és részecskeként.
- Heisenberg-féle határozatlansági elv: Nem lehet egyszerre pontosan meghatározni egy részecske helyzetét és impulzusát.
- Kvantumállapotok: Az elektronok csak meghatározott energiaszinteken létezhetnek.
A kvantummechanika segít megérteni a kémiai kötések természetét és a molekulák viselkedését, ami forradalmasította a kémiát és a anyagtudományt.
Összefoglalás: A molekulák csodálatos világa
A vegyületmolekulák olyan lenyűgöző struktúrák, amelyek atomokból, ionokból és különböző kémiai kötésekből épülnek fel. Ezek az apró építőkövek együttesen határozzák meg az anyag tulajdonságait és viselkedését. A kovalens kötések, ionos kötések, molekulapályák és intermolekuláris erők mind hozzájárulnak ahhoz a komplex tánchoz, ami a molekulák világában zajlik.
Inspiráló gondolat: Amikor legközelebb egy pohár vizet iszol, egy virágot szagolsz, vagy csak belélegzed a levegőt, gondolj arra, hogy ezek mind-mind csodálatos molekulák milliárdjaiból állnak. Minden egyes molekula egy kis csoda, egy tökéletes egyensúly az atomok és kötések között, ami lehetővé teszi az élet létezését a Földön.
A kémia nem csak tudomány, hanem egy kapu is, ami a világegyetem legmélyebb titkaihoz vezet. Ahogy egyre jobban megértjük a vegyületmolekulák felépítését és viselkedését, úgy tárulnak fel előttünk az anyag és az élet rejtélyei. Ez a tudás nem csak elméleti jelentőségű, hanem gyakorlati alkalmazásokban is megjelenik, az új gyógyszerek fejlesztésétől kezdve a környezetbarát anyagok létrehozásáig.
Legközelebb, amikor körülnézel, próbáld meg elképzelni azt a láthatatlan, de lenyűgöző molekuláris táncot, ami körülvesz minket. Ez a tudás nem csak gazdagítja a világképünket, de inspirálhat is arra, hogy felfedezzük és megóvjuk bolygónk csodáit. A kémia nem csak a laborokban létezik – ott van minden lélegzetvételünkben, minden érintésünkben, és minden pillanatban, ami az életünket alkotja.